Fyziologie výživy

Mgr. Michal Kumstát, Ph.D.
Ing. Iva Hrnčiříková, Ph.D.

© 2012 Fakulta sportovních studií Masarykovy univerzity Brno v rámci projektu Inovace studijního oboru Regenerace a výživa ve sportu pod kódem CZ.1.07/2.2.00/15.0209. Více informací o projektu: http://www.fsps.muni.cz/inovace-RVS/index.html.

Trávení a vstřebávání
http://img.blesk.cz/img/1/gallery/304546_zdravi-bricho-zaludek.jpg
Při procesu trávení jsou jednotlivé živiny (sacharidy, bílkoviny, tuky) rozkládány pomocí specifických trávicích enzymů na jednodušší látky.
Požité sacharidy (zejména ve formě disacharidů a polysacharidů), tuky (zejména triacylglyceroly) a bílkoviny jsou v tenkém střevě pomocí enzymů obsažených ve slinách, žaludeční a pankreatické šťávě rozloženy a ve formě monosacharidů, mastných kyselin, monoacylglycerolů, glycerolu, cholesterolu, peptidů a aminokyselin resorbovány do portální krve a lymfy a přiváděny tkáním a orgánům, ve kterých podléhají dalším přeměnám.
Metabolismus je soubor chemických reakcí, ve kterých se z látek zpravidla přijatých (po jejich digesci a absorpci) získává energie a látky nezbytné k výstavbě a obnově struktury a funkce buněk, tkání a celého organizmu a k udržování konstantní tělesné teploty.
Cílem velké části reakcí probíhajících v buňkách je uvolnit chemickou energii z látek přijatých potravou a přeměnit ji na formu využitelnou pro energetické zajištění celé řady procesů: svalové kontrakce, sekreční procesy, udržování membránového potenciálu aktivním transportem iontů, chemické syntézy látek, absorpční procesy ve střevě a dalších. Univerzálním zdrojem energie pro tyto procesy je ve všech buňkách adenosintrifosfát (ATP).
V následující části bude stručně popsán proces trávení nutričně nejvýznamnějších živin: sacharidů, bílkovin a tuků. V dalším textu již bude pozornost věnována pouze sacharidům a bílkovinám a bude popsán metabolismus uvedených živin v postprandiálním období (Wilhelm, 2010; Švíglerová, 2008).
Sacharidy
V běžné stravě je ze sacharidů nejvíce zastoupen polysacharid škrob, dále disacharidy laktóza a sacharóza. Trávení škrobu, který je tvořen až několika tisíci glukozovými jednotkami, je zahájeno v dutině ústní slinnou α-amylázou. Po přestupu bolu do žaludku je enzymatická aktivita α-amylázy inaktivována nízkým pH žaludeční šťávy. Trávení škrobu pokračuje intraluminárně v duodenu, kde je polysacharid vystaven působení pankreatické α-amylázy secernované do duodena pankreatickým vývodem. Polysacharid je amylázami štěpen na maltózu a α-dextrin. Maltóza je disacharid složený ze dvou molekul glukózy, α-dextrin je oligosacharid tvořený 3-10 glukozovými jednotkami.
Hlavní disacharidy z potravy (sacharóza, laktóza) a uvedené meziprodukty štěpení škrobu jsou štěpeny na úrovni kartáčového lemu enterocytů působením disacharidáz. Intracelulárně lokalizované enzymy (laktáza, sacharáza, maltáza, isomaltáza,
α-dextrináza) štěpí disacharidy a α-dextrin na monosacharidy. Laktáza štěpí laktózu na glukózu a galaktózu, sacharáza sacharózu na glukózu a fruktózu, maltáza rozkládá maltózu na dvě molekuly glukózy a α-dextrináza štěpí α-dextrin na molekuly glukózy.
Vstřebávány jsou pouze monosacharidy. Resorpce probíhá zejména v proximální části tenkého střeva. Glukóza a galaktóza jsou na luminální straně enterocytu resorbovány sekundárně aktivním transportem, který využívá koncentračního spádu sodíku do buňky. Koncentrační gradient pro Na je vytvářen NA+-K+-ATP-ázou na bazolaterální straně membrány enterocytu. Fruktóza je přes luminální membránu vstřebávána facilitovanou difůzí. V enterocytu je většina fruktózy konvertována na glukózu. Přes bazolaterální membránu přecházejí monosacharidy facilitovanou difůzí. Buněčná membrána je pro glukózu neprostupná, glukóza prochází buněčnou membránou buď za pomoci transportérů využívajících elektrochemický gradient Na+ popř. H+ (symport) nebo facilitovanou difůzí pomocí glukózových transportérů. V plasmatické membráně všech buněk existují specifické nosiče pro glukózu GLUT , které realizují přestup glukózy do buněk. Z hlediska regulačního působení inzulínu, typu transportu a zpracování glukózy tkáněmi rozlišujeme tkáně na inzulín-dependentní (svaly, tuková tkáň, játra) a inzulín independentní (mozek, erytrocyty a všechny ostatní tkáně) (Trojan, 2003, p. 321-360).
Bílkoviny
Trávení bílkovin zahajuje v žaludku enzym pepsin, vylučovaný hlavními buňkami žaludeční sliznice jako pepsinogen. Nízké pH žaludeční šťávy aktivuje pepsinogen na pepsin. V duodenu je pepsin zpět inaktivován působením zásaditého prostředí. Bílkoviny a peptidy (produkty štěpení bílkovin v žaludku) jsou vystaveny proteolytickým enzymům pankreatické šťávy (trypsin, chymotrypsin, karboxypeptidáza, elastáza). Pankreatické enzymy jsou vylučovány v neaktivní podobě a kaskádou aktivačních dějů jsou v tenkém střevě aktivovány a podílí se na luminálním štěpení bílkovin. Všechny proteolytické enzymy s výjimkou karboxypeptidázy jsou endopeptidázy - tj. štěpí peptidické vazby uvnitř bílkovinného řetězce. Produktem působení endopeptidáz jsou oligopeptidy. Karboxypeptidáza odštěpuje jednotlivé aminokyseliny od konce bílkovinného řetězce a řadíme ji mezi exopeptidázy. V kartáčovém lemu enterocytů a intracelulárně jsou lokalizovány peptidázy a aminopeptidázy, které dokončují trávení bílkovin štěpením oligopeptidů na di-, tripeptidy a jednotlivé aminokyseliny (basické, neutrální, kyselé, beta-, gama- aminokyseliny).
Bílkoviny se většinou vstřebávají jako jednotlivé aminokyseliny, méně jako oligopeptidy (di-nebo tripeptidy). Na luminální straně enterocytu jsou přenášeny buď sekundárně aktivním kotransportem se sodíkem nebo pomocí facilitované difúze. Je známo mnoho různých luminálních transportérů s afinitou pro určitou skupinu aminokyselin. Oligopeptidy jsou přes luminální stranu enterocytu vstřebávány kotransportem s H+ a intracelulárně jsou štěpeny peptidázami na aminokyseliny. Přes basolaterální stranu přestupují difúzí nebo facilitovanou difúzí (Trojan, 2003, p. 321-360).
Tuky
V běžné stravě jsou nejvíce zastoupeny triacylglyceroly (TAG), dále fosfolipidy a cholesterol. Nejdůležitějším enzymem pro trávení TAG je pankreatická lipáza. Linguální a gastrická lipáza mají u dospělého člověka za fyziologických podmínek zanedbatelný význam. Optimální lipolytický účinek pankreatické lipázy se projeví pouze v přítomnosti koenzymu kolipázy. Ta brání inhibičnímu působení žlučových kyselin na enzymatický účinek lipázy. Předchozí emulgace tuků, na které se podílí soli žlučových kyselin a lecitin, je nezbytným krokem v procesu trávení tuků. Potencuje lipolytický účinek zvětšením plochy tukových kapének. Konečnými produkty trávení lipidů jsou volné mastné kyseliny, glyceroly, mono a diacylglyceroly. Cholesterol je v potravě součástí esterů - sloučeniny mastných kyselin a cholesterolu. Estery cholesterolu jsou štěpeny pankreatickou cholesterolesterázou na cholesterol a volné mastné kyseliny. Fosfolipidy jsou tráveny pankreatickou fosfolipázou.
Natrávené tuky jsou v lumen střeva zabudovány do micel a střevní motilitou transportovány na povrch kartáčového lemu. Lipofilní látky se z micel uvolňují a difundují do enterocytu. Soli žlučových kyselin tvořící součást micel se v rámci enterohepatálního oběhu zužitkují k tvorbě žluči. Uvnitř enterocytu je většina vstřebaných tuků reesterifikována na TAG, estery cholesterolu a fosfolipidy a tyto meziprodukty jsou zabudovány chylomikronů. Chylomikrony umožňují transport lipofilních látek nejprve lymfatickým systémem a později krevním řečištěm. Tam se působením lipoproteinové lipázy mastné kyseliny uvolňují a ve vazbě na albumin cirkulují krevním řečištěm. Do krve se přímo vstřebávají pouze mastné kyseliny s kratším řetězcem (SCT , MCT ). Díky jejich hydrofilnímu charakteru nejsou integrovány do chylomikronových částic (Trojan, 2003, p. 321-360).
Uvedená vlastnost je využívána ve sportovní výživě. Navíc u MCT není transport do mitochondrií, na rozdíl od ostatních typů mastných kyselin, vázán na specifický přenašeč . Mastné kyseliny se středně dlouhým řetězcem jsou proto studovány jako pohotovostní, alternativní zdroj energie v průběhu vytrvalostního zatížení, šetřící sacharidové energetické zásoby.
Metabolismus živin v postprandiálním období
V následující kapitole budou naznačeny intermediární metabolické procesy, kterým podléhají nejjednodušší vstřebané látky. Na příkladu dávky 90 g glukózy a 30 g bílkovin (aminokyselin) budou demonstrovány základní cesty uvedených nutrientů v organismu v postprandiálním období. Dále budou popsány změny vyvolané přijatou stravou na systémové úrovni.
Intermediární metabolismus
Postprandiální období je charakterizováno změnami indukovanými příjmem potravy. Tyto změny jsou pod vlivem humorálních působků, které se podílejí na trávení, vstřebávání a metabolismu. Rozhodující význam mají změny v sekreci inzulínu a glukagonu indukované glukózou a některými aminokyselinami (Holeček, 2006, p. 215).
Nejjednodušší látky podléhají dalšímu zpracování v buňkách v procesu postupné degradace a sjednocování. Produkty trávení (glukóza, aminokyseliny, mastné kyseliny) podléhají intracelulárně štěpení na složky citrátového cyklu . Za aerobních podmínek jsou glukóza v reakcích glykolýzy a mastné kyseliny beta-oxidací degradovány na acetyl-CoA. Aminokyseliny obsahují aminoskupinu, která je uvolněna ve formě amoniaku, a v ornithinovém cyklu zpracována na netoxickou močovinu a vyloučena z těla ven. Zbylé uhlíkaté kostry aminokyselin se transaminačními a deaminačními reakcemi přeměňují na intermediáty citrátového cyklu . Následná degradace acetyl-CoA (2 uhlíky) již probíhá v mitochondriích v citrátovém cyklu. V různých fázích cyklu do něj vstupují i odbourané aminokyseliny. V reakcích cyklu vznikají 2 molekuly CO2 a uvolňuje se vodík vázaný na oxidoredukční enzymy. Tyto dehydrogenázy vstupují do dýchacího řetězce, spřaženého procesu s citrátovým cyklem, kde ztrácejí elektrony za vzniku H+ a uvolňuje se energie. Elektrony se postupně přenášejí na kyslík, získaný z oxygenovaného hemoglobinu a společně s H+ se tvoří voda. Uvolněná energie se transformuje oxidativní fosforylací do molekuly ATP. Výsledkem kompletní degradace živin jsou konečné produkty metabolismu čtyř základních biogenních prvků - CO2, H2O, NH3, ATP (Řezáčová & Stoklasová, 2008, p. 37-44).
Uvedené reakce generující ATP jsou významně ovlivněny tím, zda převažuje nabídka substrátů, či se mobilizují endogenní pohotovostní zdroje energie. Organismus disponuje endogenními (zásoby TAG, glykogenu nebo metabolismus laktátu a ketolátek) a exogenními (příjem potravou) zdroji energie.
Postprandiální období
Představíme-li si příjem potravy jako zdroj energetických substrátů, můžeme s ohledem na variabilitu příjmu v čase definovat různá stadia metabolismu člověka. Změny indukované příjmem potravy (postprandiální), metabolismus živin a nalačno (postresorpční) a metabolismus živin při hladovění (katabolismus) a změny vyvolané pohybovým zatížením. Charakteristika všech uvedených situací by byla nad rámec práce a zaměříme se proto pouze na charakteristiku postprandiálního období. V postprandiálním období jsou živiny v organismu utilizovány charakteristickým způsobem. Ten je určen zejména nabídkou endogenních a exogenních substrátů. Rychlost resorpce základních nutrientů - glukózy, aminokyselin a mastných kyselin se velmi liší. Velmi rychle se vstřebávají glukóza a aminokyseliny a uplatňuje se jejich vliv na sekreci inzulínu a glukagonu.
Charakteristické pro postprandiální fázi, kdy převažují anabolické děje, je utilizace exogenních zdrojů glukózy prakticky všemi orgány. Přes výraznou utilizaci glukózy a aminokyselin v játrech dochází během 30 min. po příjmu potravy k výraznému nárůstu u koncentrací těchto látek v krevním řečišti (Holeček, 2006, p. 215). Přebytek glukózy je polymerizován na zásobní glykogen, popř. využit k syntéze TAG. Organismus disponuje omezenou kapacitou pro ukládání glykogenu (~ 350 g u dospělého člověka) a pro bílkoviny zásobní podoba v organismu neexistuje. Holeček (2006, p. 147) uvádí tzv. aminokyselinový pool. Jde o aminokyselinovou hotovost, která je využívána pro biosyntézu proteinů, hormonů, nukleových kyselin atd.
Model základních cest glukózy a aminokyselin
Obr. 8 představuje jednoduchý model základních metabolických drah po přijetí 90 g glukózy. Řada buněk v tomto období využívá glukózu obligatorně, např. CNS, erytrocyty, trombocyty, ledviny, myokard, kosterní svalstvo. V anabolické fázi je inzulínem inhibovaná jaterní produkce glukózy a stimulována nejprve glykogeneze (30-40 % je utilizováno játry a 50-60 % svaly) a poté lipogeneze (Stipanuk, 2006, p. 546).
Paralelně je v játrech utilizován produkovaný laktát (tvořený např. enterocyty, erytrocyty a buňkami CNS) a prostřednictvím glukoneogeneze (nepřímo) rovněž přispívá k syntéze glykogenu. Podle některých autorů až z 30-40 % (Stipanuk, 2006, p. 546).
Většina glukózy z našeho modelu je oxidována kosterním svalstvem (45 g), dále mozkovou tkání (15-20 g).
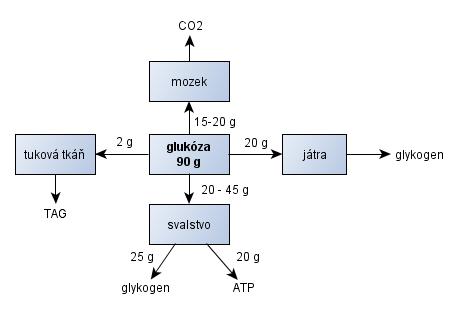
Obr. 8 - Hlavní dráhy přijaté glukózy v postprandiální fázi (~ 2 h) - upraveno podle (Stipanuk, 2006)
Obdobně je možné charakterizovat hlavní metabolické dráhy přijatých bílkovin (obr. 9). Většina vstřebaných aminokyselin je v játrech využita k syntéze proteinů, lipoproteinů, glukózy a jako zdroj energie. Výjimku tvoří větvené aminokyseliny (BCAA) . Hlavním místem jejich utilizace je kosterní sval, kde podporují proteosyntézu a slouží jako zdroj energie (Holeček, 2006, p. 216).
Nejen z tohoto důvodu jsou BCAA důležitým doplňkem výživy sportovců . Absence zásobní formy bílkovin v organismu determinuje poměr využitý k proteosyntéze a degradaci, popř. oxidaci. Po příjmu 30 g aminokyselin je přibližně 20 g katabolizováno (glutamin v enterocytech, část BCAA kosterním svalstvem a zbytek játry) (Stipanuk, 2006, p. 547-548).
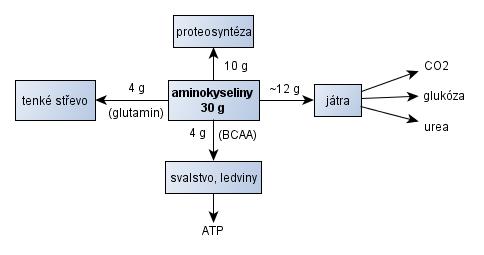
Obr. 9 - Hlavní dráhy přijatých bílkovin (aminokyselin) v postprandiální fázi (~ 2 h) - upraveno podle (Stipanuk, 2006)
Několik hodin po posledním příjmu potravy nastává postresorpční období ve kterém je organismus závislý na zásobních zdrojích energie (zejména glykogenu pro zisk glukozy). Rozvíjí se rovněž glukoneogeneze.
Glukoneogeneze
Část glukózy vytvořené v játrech z laktátu je ve svalech přeměněna na laktát, který je uvolněn do krve a následně opět použit pro syntézu glukózy (uzavřený cyklus). Protože pro pracující sval je hlavním zdrojem glukózy svalový glykogen, představuje Coriho cyklus možnost jak využít glukózu získanou štěpením svalového glykogenu přo jiné tkáně. Glykogen je tak možné využít jako zdroj glukózy pro potřeby celého organismu, přestože ve svalech není přítomna glukoza-6-fosfatáza.
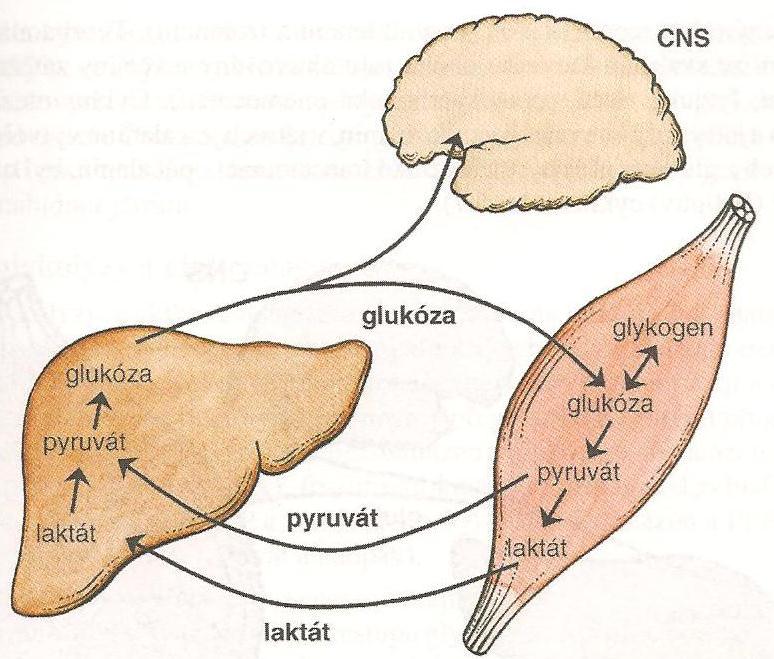
Obr. 10 - Coriho cyklus - převzato z (Holeček, 2006)
Mezi glukogenní látky patří také řada aminokyselin (alanin, arginin, glutamin kys.asparagová, cystin, fenylalanin…). Nejvýznamnější glukoplastickou aminokyselinou je alanin. Vzniká v kosterním svalstvu z pyruvátu (katabolismem glykogenu) a zbytků větvených aminokyselin (aminoskupina BCAA). Cyklus, který probíhá mezi kosterním svalstvem a játry a uplatňuje se u většiny zátěžových stavů (hladovění, fyzická aktivita) se nazývá alaninový cyklus.
Ve svalech vzniká alanin a v játrech je z něj syntetizována glukóza, aby byla následně svaly opět použita a prostřednictvím pyruvátu transaminací vznikl alanin. Takto uvolněná glukóza je využita řadou tkání, zejména obligatorně závislých na glukóze.
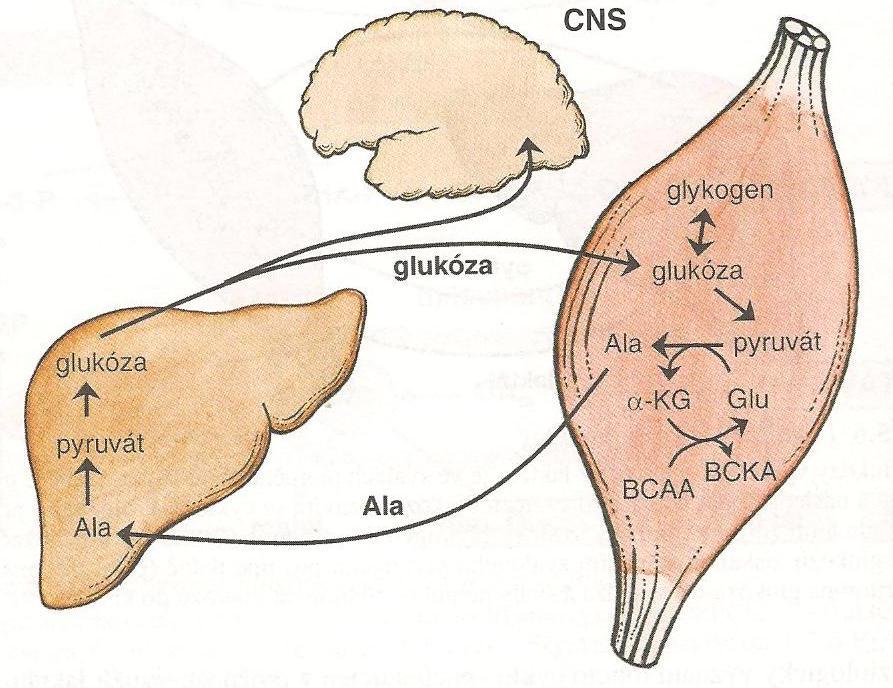
Obr. 11 - Alaninový cyklus - převzato z (Holeček, 2006)
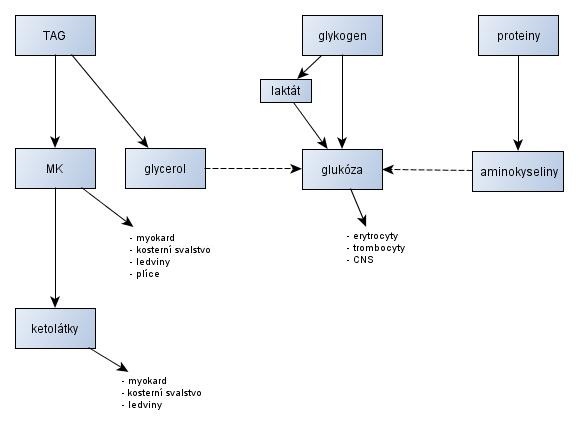
Obr. 12 - Základní metabolické cesty během postresorpční fáze metabolismu - upraveno podle (Wilhelm, 2010)
Změny v prokrvení splanchniku
V postprandiálním období dochází k rozsáhlé redistribuci krve v rámci klíčových orgánů. Zvýšené prokrvení splanchniku po příjmu potravy není navozeno přímým působením parasympatiku, neboť cévy jsou inervovány sympatikem. Lokální změny v poměru ATP/ADP, pokles pH, vzestup pCO2 a další faktory nepřímo ovlivňují míru vasodilatace.
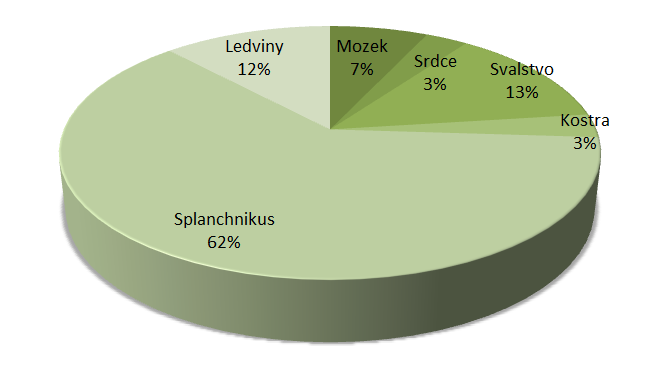
Srovnání jednotlivých orgánů a jejich podílu na klidovém minutovém srdečním výdeji uvádí v publikaci Lékařská fyziologie Trojan (2003, s. 272-273).
Zřejmý je významný nárůst klidového minutového výdeje srdečního (MV) v trávicím traktu v postprandiálním období. Souvisí s redistribucí krve do oblasti splanchnika. Uvedená situace je logicky doprovázena i změnou v energetických nárocích spojených s procesy trávení a vstřebávání jednotlivých živin.
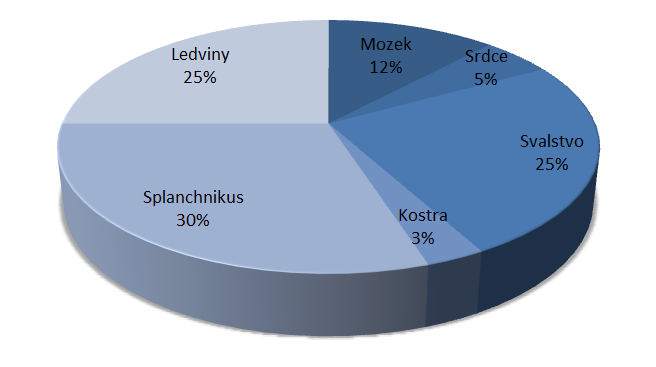
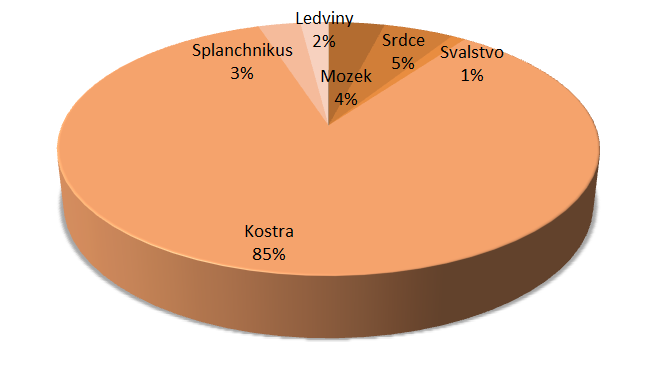
Obr. 13 - Minutový srdeční výdej v klidu (6 l/min) - upraveno podle (Trojan, 2003)
Obr. 14 - Minutový srdeční výdej po vydatném jídle (12 l/min) - upraveno podle (Trojan, 2003)
Obr. 15 - Minutový srdeční výdej při zatížení (25 l/min) - upraveno podle (Trojan, 2003)
Shrnutí základních metabolických charakteristik v postprandiálním období:
- Roste inzulinémie - dostatečný přísun živin stačí krýt energetické požadavky buněk zejména utilizací glukózy, glukóza je hlavním zdrojem pro syntézu glykogenu v játrech i svalech a tuku (TAG) v tukové tkáni;
- v játrech dochází k syntéze lipoproteinových částic;
- některé aminokyseliny jsou metabolizovány v enterocytech na alanin, laktát a využity v procesu glukoneogeneze; v játrech a kosterním svalstvu dochází k proteosyntéze a rovněž k odbourávání amoniaku a syntéze močoviny;
- nadbytek bílkovin je oxidován na CO2 a H2O;
- lipidy jsou využity jako zdroj energie pro kosterní svalstvo, k syntéze lipoproteinů a nadbytek přeměněn na zásobní formu (TAG).
Holeček (2006, s. 217) přehledně graficky shrnuje metabolické dopady v kosterním svalstvu, játrech, ledvinách a tukové tkáni, které s sebou postprandiální období přináší.
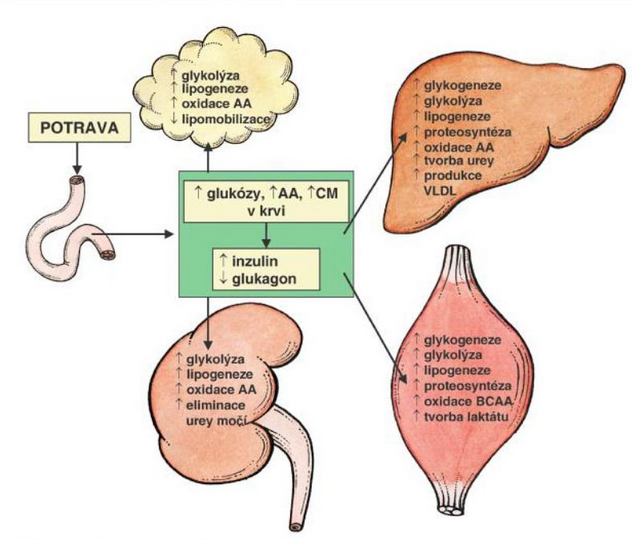
Obr. 16 - Postprandiální fáze metabolismu - převzato z (Holeček, 2006)
Přeměna energie v teplo
Ne veškerá energie přijatá potravou je organismu k dispozici. Část energie se ztrácí vlivem nekompletního zpracování trávicím traktem (~5-10 %). Obr. 17 zobrazuje využití vstřebané -dostupné energie. Přibližně 50 % energie vzniklé oxidací energetických substrátů je uvolněno v podobě tepla, bez tvorby ATP. V klidových podmínkách jsou primárním energetickým substrátem tuky a glukóza.
Pouze 2 - 5 % energetických potřeb organismu kryje katabolismus bílkovin (McArdle et al., 2007, p. 38).
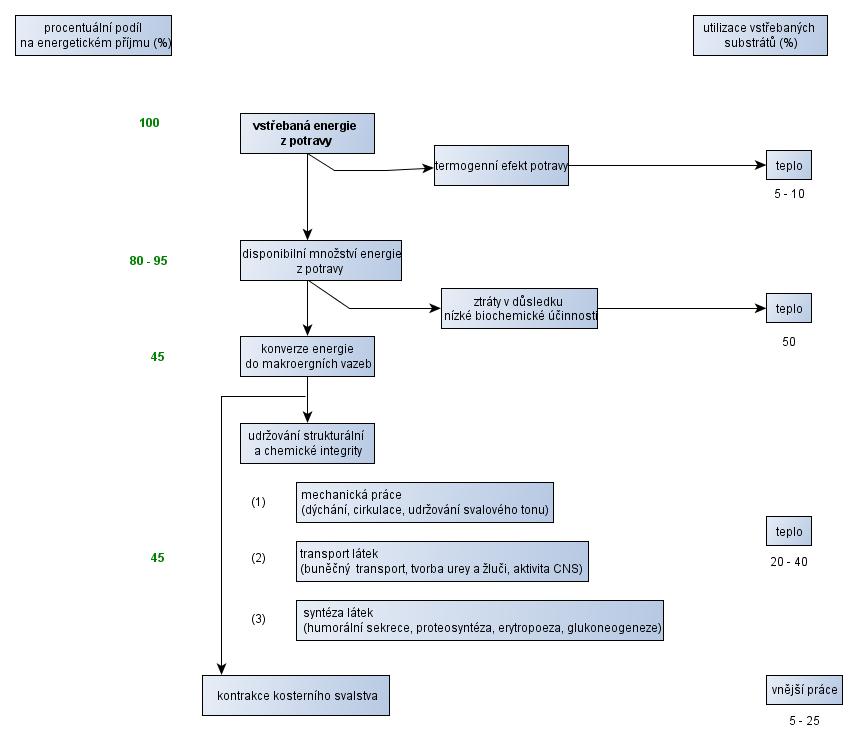
Obr. 17 - Účinnost přeměny exogenních zdrojů energie na práci a teplo - upraveno podle (Stipanuk, 2006)
Účinnost energetických dějů v organismu vyjádřená podílem (%) na celkovém množství exogenních zdrojů energie (chemická energie) zbývajícím k vykonání vnější práce se pohybuje ≤ 25 %.
Obdobně, ovšem pro pohybovou aktivitu nízké intenzity, uvádí i McArdle et al., 2007 (p. 211). Domácí autoři uvádí hodnoty o něco vyšší.
Energie vzniklá štěpením vazeb organických molekul se z 60 % (Kittnar, O., 2011, p. 470),
resp. 66 % (Trojan, 2003, p. 405) přemění na teplo a zbytek je využit k práci.